
¡Bienvenidos chicos una semana más! Esta vez os presento las proteínas, que es en definitiva mi tema favorito
Las proteínas son biomoléculas orgánicas cuya composición principal son los aminoáacidos.
Estos son compuestos orgánicos sencillos, de bajo peso molecular. Se unen entre sí f.
- Químicamente están formados por C, H, O y N, presentan grupos carboxilo y amino.
-Todos ellos van unidos mediante un enlace covalente al carbono .
- Son sólidos, se disuelven en agua, se pueden cristalizar y son casi incoloros ,su punto de fusión elevado y con actividad óptica, es decir, forma dextrógira o levógira
Existen 20 aminoácidos proteicos y 150 aminoácidos no proteicos.
Según su polaridad se clasifican en:
Hidrófobos. Ala, Val, Leu, Ile, Pro, Met, Phe y Trp.
Hidrofílicos (polares).Sin carga. Ser, Thr, Gln, Asn, Tyr, Cys, Gly.
Ácidos: Asp, Glu.
Básicos: Lys, Arg, His.

Las propiedades de los aminoácidos, son principalmente:
Caracter anfótero regulan el ph cediendo o captando protones
En disolución acuosa forman iones dipolares o híbridos, que tienen el mismo número de cargas positivas y negativas. El pH al que se forman los iones híbridos se llama punto isoeléctrico.
Elevado punto de fusión +200 grados
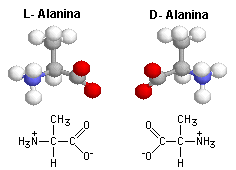
Pueden presentar dos configuraciones espaciales D y L según sea la orientación del grupo amino -NH2, a la derecha o la izquierda.
Todos los aminoácidos proteicos aparecen como el estereoisómero L.
Presentan actividad óptica, desviando el plano de luz polarizada hacia la derecha (dextrógiros) o hacia la izquierda (levógiros)
Hay algunos aminoácidos que no se pueden sintetizar con la dieta. Estos son los aminoácidos esenciales.
Son Val, Leu, Ile, Met, Phe, Trp, Thr, Lys. Los lactantes tampoco sintetizan His.
Los aminoácidos se unen entre sí por un enlace llamado enlace peptídico
El enlace tiene lugar entre el grupo carboxilo de un aminoácido y el grupo amino del siguiente aminoácido, perdiéndose una molécula de agua.
Los grupos amino y carboxilo que quedan libres en los extremos de los péptidos se llaman N-terminal y C-terminal.
Este es un enlace corto, no permite que los átomos giren libremente.Los cuatro átomos que forman parte del enlace peptídico y los dos átomos de C a los que se unen, se encuentran en un plano.
Según el número de aminoácidos que se unen en el enlace encontramos:
Dipéptidos: Unión de dos aminoácidos.
Tripéptidos: Unión de tres aminoácidos.
Oligopéptidos: Tiene menos de 50 aminoácidos.
Polipéptido: Tiene más de 50 aminoácidos.
Las proteínas , según su complejidad tienen cuatro formas diferentes de disponerse:
Estructura primaria
La estructura primaria viene determinada por la secuencia de aminoácidos en la cadena proteica, es decir, el número de aminoácidos presentes y el orden en que están enlazados
Como consecuencia del establecimiento de enlaces peptídicos entre los distintos aminoácidos que forman la proteína se origina una cadena principal
Los enlaces que participan en la estructura primaria de una proteína son covalentes: son los enlaces peptídicos.
Estructura secundaria
La estructura secundaria de las proteínas es el plegamiento que la cadena polipeptídica adopta gracias a la formación de puentes de hidrógeno entre los átomos que forman el enlace peptídico. Los puentes de hidrógeno se establecen entre los grupos -CO- y -NH- del enlace peptídico . De esta forma, la cadena polipeptídica es capaz de adoptar conformaciones de menor energía libre, y por tanto, más estables.
Hélice alfa
En esta estructura la cadena. Esta estructura se mantiene gracias a los enlaces de hidrógeno intracatenarios formados entre el grupo -NH de un enlace peptídico y el grupo -C=O del cuarto aminoácido que le sigue.
Cuando la cadena polipeptídica se enrolla en espiral sobre sí misma debido a los giros producidos en torno al carbono alfa de cada aminoácido se adopta una conformación denominada hélice α.
Hoja plegada
Cuando la cadena principal de un polipéptido se estira al máximo que permiten sus enlaces covalentes se adopta una configuración espacial denominada estructura β,. En esta estructura las cadenas laterales de los aminoácidos se sitúan de forma alternante a la derecha y a la izquierda del esqueleto de la cadena polipeptídica. Las estructuras β de distintas cadenas polipeptídicas o bien las estructuras β de distintas zonas de una misma cadena polipeptídica pueden interaccionar entre sí mediante puentes de hidrógeno, dando lugar a estructuras laminares llamadas por su forma hojas plegadas u hojas β.
Cuando las estructuras β tienen el mismo sentido, la hoja β resultante es paralela, y si las estructuras β tienen sentidos opuestos, la hoja plegada resultante es antiparalela.
Hélice de colágeno
Es una variedad particular de la estructura secundaria, característica del colágeno. El colágeno es una importante proteína fibrosa presente en tendones y tejido conectivo con función estructural ya que es particularmente rígida.
Son regiones de proteínas que adoptan una estructura en zigzag y se asocian entre sí estableciendo uniones mediante enlaces de hidrógeno intercatenarios. Todos los enlaces peptídicos participan en estos enlaces cruzados, confiriendo así gran estabilidad a la estructura. La forma en beta es una conformación simple formada por dos o más cadenas polipeptídicas paralelas
Estructura y Propiedades de las Proteínas
antíparalelas (que corren en direcciones opuestas) y se adosan estrechamente por medio de puentes de hidrógeno y diversos arreglos entre los radicales libres de los aminoácidos. Esta conformación tiene una estructura laminar y plegada, a la manera de un acordeón.
Estructura terciaria
Se llama estructura terciaria a la disposición tridimensional de todos los átomos que componen la proteína, concepto equiparable al de conformación absoluta en otras moléculas. La estructura terciaria de una proteína es la responsable directa de sus propiedades biológicas, ya que la disposición espacial de los distintos grupos funcionales determina su interacción con los diversos ligandos. Para las proteínas que constan de una sola cadena polipeptídica (carecen de estructura cuaternaria), la estructura terciaria es la máxima información estructural que se puede obtener.
• Proteínas con estructura terciaria de tipo globular, más frecuentes, en las que no existe una dimensión que predomine sobre las demás, y su forma es aproximadamente esférica. En este tipo de estructuras se suceden regiones con estructuras al azar, hélice a hoja b, acodamientos y estructuras supersecundarias.
Las proteínas fibrosas se caracterizan porque sus cadenas peptídicas forman moléculas alargadas e insolubles en agua y en disoluciones salinas por presentar un predominio de cadenas R hidrófobas. Desempeñan, fundamentalmente, funciones estructurales.
Las fuerzas que estabilizan la estructura terciaria de una proteína se establecen entre las distintas cadenas laterales de los aminoácidos que la componen. Los enlaces propios de la estructura terciaria pueden ser de dos tipos: covalentes y no covalentes.
• Los enlaces covalentes pueden deberse a la formación de un puente disulfuro entre dos cadenas laterales de Cys, o a la formación de un enlace amida
enlaces no covalentes pueden ser de cuatro tipos:
fuerzas electrostáticas entre cadenas laterales ionizadas, con cargas de signo opuesto
puentes de hidrógeno, entre las cadenas laterales de AA polares interacciones hidrofóbicas entre cadenas laterales apolares
fuerzas de polaridad debidas a interacciones dipolo-dipolo
Como resultado de estas interacciones, en las proteínas con estructura terciaria globular:
• Las cadenas laterales con carácter apolar se orientan hacia el interior de la molécula evitando las interacciones con el disolvente, y forman un núcleo compacto con carácter hidrofóbico.
Las cadenas laterales de los aminoácidos polares se localizan en la superficie de la molécula, interaccionando con el agua y permitiendo que la proteína permanezca en disolución.
Estructura cuaternaria
Cuando una proteína consta de más de una cadena polipeptídica, es decir, cuando se trata de una proteína oligomérica, decimos que tiene estructura cuaternaria.
La estructura cuaternaria deriva de la conjunción de varias cadenas peptídicas que, asociadas, conforman un multímero, que posee propiedades distintas a la de sus monómeros componentes. Dichas subunidades se asocian entre sí mediante interacciones no covalentes, como pueden ser puentes de hidrógeno, interacciones hidrofóbicas o puentes salinos. Para el caso de una proteína constituida por dos monómeros, un dímero, éste puede ser un homodímero, si los monómeros constituyentes son iguales, o un heterodímero, si no lo son. En cuanto a uniones covalentes, también pueden existir uniones tipo puente disulfuro entre residuos de cisteína situados en cadenas distintas.
CLASIFICACIÓN DE LAS PROTEÍNAS.
. Según su conformación
1. Proteínas fibrosas (colágeno, α-queratina)
2. Proteínas globulares (hemoglobina, enzimas)
Según su composición
1. Holoproteínas (proteínas simples)
- Por hidrólisis sólo producen aminoácidos .
Heteroproteínas (proteínas conjugadas)
- Por hidrólisis producen aminoácidos y otro componente orgánico o inorgánico. - La parte no aminoácida de las heteroproteínas se denomina grupo prostético. - En función del grupo prostético estas proteínas se pueden clasificar en:
a. Cromoproteínas : el grupo prostético es un pigmento.
En la hemoglobina, la mioglobina y el citocromo c, el pigmento es unametalporfirina (anillo tetrapirrólico). En la rodopsina el pigmento es un derivado de la vitamina A
b. Glucoproteínas : tienen un glúcido como grupo prostético. Si el porcentaje de glúcidos es muy elevado reciben el nombre de proteoglucanos , como las mucoproteínas (80% de glúcidos).
Ejemplos: fibrinógeno, inmunoglobulinas, FSH, TSH, pepsina, ovoalbúmina y glucoproteínas de la membrana..
c. Lipoproteínas : con un lípido como grupo prostético.
Las lipoproteínas del plasma sanguíneo (VLDL, LDL y HDL) son ejemplos de este grupo.
d. Nucleoproteínas : proteínas unidas a ácidos nucleicos.
Como las que constituyen los ribosomas o las partículas virales.
e. Fosfoproteínas : presentan grupos fosfato.
La caseína de la leche o la vitelina del huevo son fosfoproteínas.
f. Metaloproteínas : poseen átomos metálicos .
La ferritina que se encuentra en el bazo tiene Fe(OH)3 como grupo prostético.
C. Según sus funciones
1. Enzimas (biocatalizadores)
- Aceleran las reacciones del metabolismo. Se conocen más de dos mil, entre ellos la ADN-polimerasa (interviene en la síntesis del ADN), la pepsina (enzima que digiere las proteínas en el estómago) o el citocromo c (transfiere elec- trones en la cadena respiratoria).
2. Proteínas de reserva
- Almacenan aminoácidos como elementos nutritivos o como sillares para el embrión en crecimiento. La caseína de la leche o la ovoalbúmina de la clara del huevo son proteínas de reserva.
3. Proteínas transportadoras
- Son proteínas capaces de unirse a diversos tipos de moléculas para transportarlas. La hemoglobina y la hemociani- na son responsables del transporte de oxígeno en los vertebrados y en algunos invertebrados respectivamente. La
mioglobina transporta oxígeno en los músculos. La seroalbúmina de la sangre transporta ácidos grasos desde el te- jido adiposo a otros órganos. Las lipoproteínas del plasma sanguíneo (VLDL, LDL y HDL) transportan lípidos entre el intestino, el hígado y los tejidos adiposos.
4. Proteínas contráctiles
- La actina y la miosina son las principales responsables de contracción muscular. 5. Proteínas protectoras o defensivas
- La trombina y el fibrinógeno son proteínas plasmáticas que participan en la coagulación de la sangre. Los anticuer- pos o inmunoglobulinas (γ-globulinas) son proteínas específicas que se combinan con las moléculas extrañas que penetran en el organismo y las neutralizan.
6. Toxinas
- Algunas proteínas son sustancias extremadamente tóxicas para los animales en cantidades muy pequeñas. Una cienmilésima de gramo de la toxina A producida por el Clostridium botulinum , responsable de algunas intoxicacio- nes alimentarias, es suficiente para matar a una persona. La toxina diftérica y los venenos de serpiente son tam- bién proteínas.
7. Hormonas
- Las hormonas insulina (regula el metabolismo de la glucosa), STH (hormona del crecimiento), ACTH (hormona adrenocorticotrópica), FSH (hormona estimulante del folículo) y TSH (hormona estimulante del tiroides) son de na- turaleza proteica.
8. Proteínas estructurales
- El colágeno es la principal proteína estructural en los tejidos conectivos y en el hueso. La α-queratina es el principal componente de la capa superficial de la piel, de los pelos, las plumas y las uñas. También podemos citar aquí las glucoproteínas de las membranas celulares y las mucoproteínas o mucinas (proteínas asociadas a mucopolisacári- dos) de las secreciones mucosas
Y sus propiedades son :
1. Solubilidad.
Los radicales R polares localizados en la superficie externa de las proteínas establecen enlaces de hidrógeno con el agua. La proteína se va a rodear de una capa de agua que impide su unión con otras proteínas y, por tanto, su precipitación. En general, las proteínas fibrosas son insolubles en agua.
2.Desnaturalización.
Rotura de los enlaces que mantienen el estado nativo de la proteína ,que es el estado más estable de una proteína plegada, y tiene la menor energía libre a partir de los enlaces no covalentes entre los aminoácidos y cualquier grupo prostético. Se mantienen los enlaces peptídicos que mantienen la estructura primaria, la cual adopta una forma filamentosa.
- Se pierden las estructuras secundaria, terciaria y cuaternaria, con ello pierden su actividad biológica.
- La proteína desnaturalizada suele precipitar, ya que los grupos hidrofóbicos antes encerrados en el interior de la proteína salen a las zonas externas, estableciendo interacciones y agrupándose.
- La desnaturalización puede ser provocada por varios factores, como pH, Temperatura, polaridad del disolvente o sustancias desnaturalizantes (urea).
Polaridad del disolvente: Esta disminuye al añadir sustancias menos polares que el agua (etanol, acetona), con lo que también disminuye el grado de hidratación de los grupos iónicos superficiales de la proteína, provocando su precipitación. Los disolventes orgánicos interaccionan con el interior hidrófobo de las proteínas, desorganizando la estructura terciaria y provocando su desnaturalización y precipitación.
Urea: Va a aumentar la fuerza iónica del medio, por lo que también disminuye el grado de hidratación de los grupos iónicos de la proteína. La urea compite por el agua y rompe los puentes de hidrógeno, de forma que las proteínas se agregan y precipitan.
pH: Los OH-y los H+ afectan a la envoltura acuosa de las proteínas y a la carga eléctrica de los grupos ácidos y básicos de las cadenas laterales de los aminoácidos. Así se eliminan las interacciones electrostáticas que estabilizan la estructura terciaria, produciéndose su precipitación.
Temperatura: Al elevar la Temperatura, aumenta la energía cinética de las moléculas, con lo que se desorganiza la envoltura acuosa de las proteínas y se van a desnaturalizar. También destruye las interacciones débiles y se desorganiza la estructura de la proteína, de forma que el interior hidrófobo interacciona con el medio acuoso, produciéndose la agregación y precipitación de la proteína desnaturalizada.
Cuando una proteína se desnaturaliza, generalmente adopta una conformación filamentosa y precipita. Esto se debe a que la capa de moléculas de agua ya no recubre totalmente las moléculas proteicas, entonces estas tienden a unirse y dan
PROTEÍNAS
lugar a grandes condensaciones que precipitan. Las proteínas desnaturalizadas no pueden realizar funciones de tipo enzimático, transportador u hormonal.
- La desnaturalización puede ser reversible, produciéndose una renaturalización: las proteínas pueden replegarse y adoptar nuevamente su conformación nativa, recuperando la actividad biológica perdida cuando la desnaturalización no ha afectado a los enlaces peptídicos.
3. Especificidad.
De función. Depende de la posición que ocupan determinados aminoácidos de los que constituyen su secuencia lineal. Esta secuencia condiciona la estructura cuaternaria, responsable de la función específica de las proteínas. Una pequeña variación en la secuencia de aminoácidos puede suponer la pérdida de la función.
De especie. Existen proteínas exclusivas de cada especie. Las proteínas que desempeñan la misma función en distintas especies suelen tener una composición y estructura similares y se denominan proteínas homólogas. Ejemplo: La cadena A de la insulina es idéntica en humanos, perros, cerdos, conejos y cachalotes. Esto origina problemas a la hora de trasplantes.
4. Capacidad amortiguadora.
Debido al comportamiento anfótero pueden comportarse como ácidos o como bases, liberando o retirando H+ del medio. Así amortiguan las variaciones de pH del medio en el que se encuentran.









Para dar más detalles os dejo la tabla de las estructuras hechas en grupo
Además para una visión general de este tema os dejo mi esquema



